量子力學(Quantum Mechanics) 是20世紀物理學最偉大的革命之一,它描述的是「微觀世界」(原子、電子、光子、分子等極小尺度)的物理行為,與我們日常經驗的「經典物理」(牛頓力學、電磁學)完全不同。
量子力學是描述粒子:
- 同時具有「波動性」與「粒子性」
- 狀態可以「疊加」
- 測量會「瞬間塌縮」
- 兩個粒子可以「量子糾纏」的物理理論
。
量子力學的幾個最核心、也最違反直覺的概念(通俗解釋):
- 波粒二象性
電子、光子這些粒子,既像粒子(有明確位置),又像波(會發生干涉、繞射)。
→ 著名的「雙縫實驗」:電子一個一個打出去,卻能在螢幕上形成干涉條紋,像波一樣。 - 量子疊加(Superposition)
在沒被觀測之前,一個量子系統可以同時處於多種狀態的「疊加」。
→ 最有名的比喻:薛丁格的貓——在打開盒子前,貓同時處於「又活又死」的疊加態。 - 測量塌縮(Wave function collapse)
一旦你去「觀測」或「測量」,疊加態會瞬間塌縮成單一確定狀態。
→ 這就是為什麼你永遠看不到「半死半活的貓」,一觀測就變成明確的活或死。 - 量子糾纏(Entanglement)
兩個粒子一旦糾纏,它們的狀態會瞬間關聯,即使相隔光年之遠,測量其中一個,另一個會瞬間改變。
→ 愛因斯坦稱之為「鬼魅般的超距作用」(spooky action at a distance)。 - 不確定性原理(海森堡不確定性原理)
你不可能同時精確知道一個粒子的「位置」和「動量」(速度×質量)。知道越準確,另一個就越模糊。
→ 微觀世界沒有「絕對精確的軌道」這種東西。 - 能量量子化
能量不是連續的,而是像樓梯一樣一階一階的(量子)。
→ 這解釋了為什麼原子光譜是分立的線,而不是連續的彩虹。
量子力學的數學基礎(簡單說)
- 粒子的狀態用「波函數」ψ 描述
- |ψ|² 表示在某位置找到粒子的機率密度
- 核心方程:薛丁格方程(Schrödinger Equation)
iℏ ∂ψ/∂t = Ĥψ (描述波函數如何隨時間演化)
為什麼量子力學這麼重要?
- 所有現代科技的基石:半導體、晶片、雷射、MRI、GPS、量子電腦…全部靠量子力學
- 解釋了化學鍵、物質結構、太陽為什麼能發光
- 正在引發第二次量子革命(量子計算、量子通訊、量子感測)
一句最白話的總結:
「在原子世界裡,東西不是『確定在那裡』,而是『有機率在那裡』;你不去看它時,它可以同時在好幾個地方、好幾種狀態;你一看,它才『決定』要變成哪一種。」這就是量子力學最顛覆之處——它告訴我們:宇宙在最深層的本質,是機率、疊加與糾纏,而非我們直覺中的「確定性」。
原子軌域(atomic orbital)完全屬於量子力學的核心概念,而且是量子力學最經典、最重要的應用之一。
為什麼原子軌域「只能用量子力學」來解釋?
| 經典物理(波耳模型以前) | 量子力學(軌域模型) |
|---|---|
| 假設電子像行星一樣在固定軌道繞原子核跑 | 電子根本沒有固定軌道! |
| 電子應該會持續輻射電磁波,能量越來越少,最後掉到原子核 | 完全違反實驗!原子是穩定的 |
| 無法解釋化學鍵、光譜為什麼是一條一條的線 | 完美解釋 |
原子軌域到底是什麼?(白話版)
原子軌域不是「電子跑的小路」,而是:「電子在原子周圍出現的機率雲」或者說:「電子在空間某個區域被找到的機率密度分佈」
- 1s 軌域 → 球形雲,越靠近原子核機率越高
- 2p 軌域 → 啞鈴形,有兩個葉片
- 3d 軌域 → 更複雜的花瓣或四葉形
這些形狀全部來自薛丁格方程的解!
關鍵的量子力學來源(四個量子數)
每個原子軌域都由四個量子數完全決定,這四個數字全部來自量子力學:
- 主量子數 n(1, 2, 3…)→ 決定能量與大小
- 角量子數 ℓ(0 到 n-1)→ 決定形狀(s, p, d, f)
- 磁量子數 mℓ → 決定空間方向
- 自旋量子數 ms(+1/2 或 -1/2)→ 電子自旋
沒有量子力學,這四個量子數根本不存在,也就沒有軌域的概念。
歷史小結
- 1913年:波耳模型(還是有軌「道」)→ 半經典
- 1926年:薛丁格發表波動力學 + 海森堡矩陣力學 → 真正量子力學
- 1926-1927年:誕生了「軌域(orbital)」這個詞(取代了舊的「軌道 orbit」)
- 1930年代:軌域圖像變成現代化學的基礎(保羅原理、洪德規則、构造原理)
結論:
原子軌域不是「有點量子」,而是「100% 量子力學的產物」。如果沒有量子力學,就不會有 s、p、d、f 軌域,也不會有現代化學鍵理論、週期表解釋、半導體、雷射……幾乎所有現代科技都會崩塌。
所以當你看到課本畫的那些球形、啞鈴形、四葉草形狀時,請記得:那不是電子在跑的路,而是「量子機率雲」的視覺化——這就是量子力學最美的畫作之一。
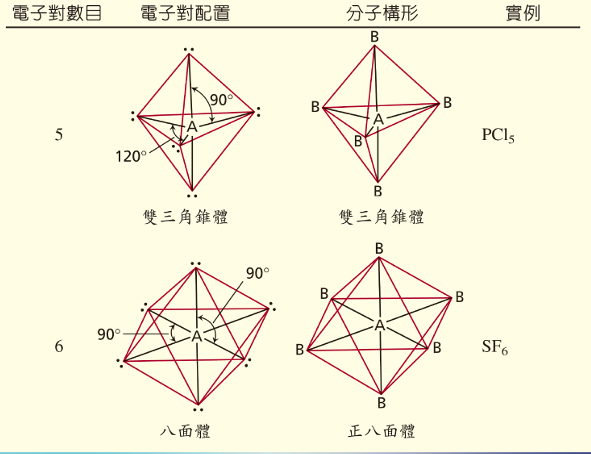
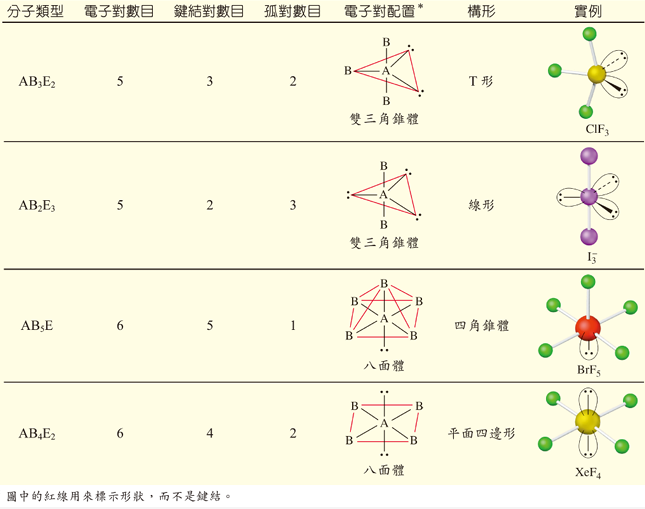
原子軌域、分子軌域和混成軌域是描述分子中電子分佈的三個相關概念
- 原子軌域: 指的是單一原子中電子出現的機率區域,例如
ss𝑠、
pp𝑝、
dd𝑑軌域。
- 混成軌域: 指的是在形成化學鍵前,同一原子中能量相近的軌域(如
ss𝑠軌域和
pp𝑝軌域)重新組合而成的等價新軌域。它用於解釋分子結構,例如甲烷的
sp3s p cubed𝑠𝑝3混成軌域形成正四面體結構。
- 分子軌域: 指的是在分子中,電子同時在多個原子核之間運動的區域。它是原子軌域組合而成,通常使用「原子軌域線性組合」(LCAO-MO)方法來描述。
總結來說,原子軌域是原子的基本組成部分,分子軌域描述了整個分子的電子行為,而混成軌域則是原子軌域在分子鍵結過程中重組後形成的新軌域,用來解釋分子結構和鍵結特性。
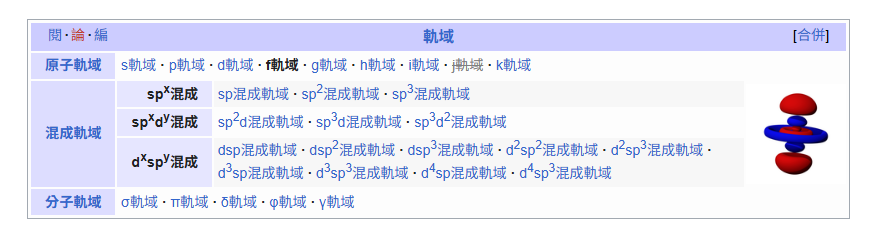
原子軌域
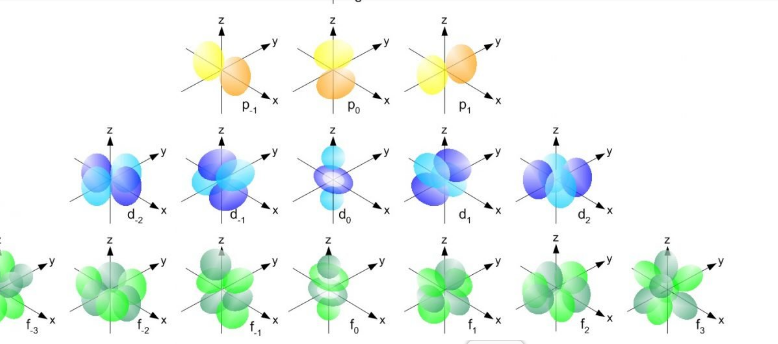
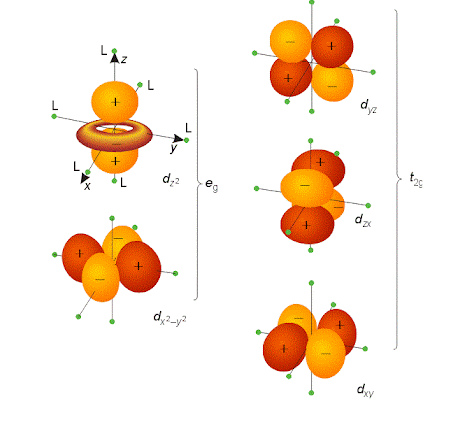
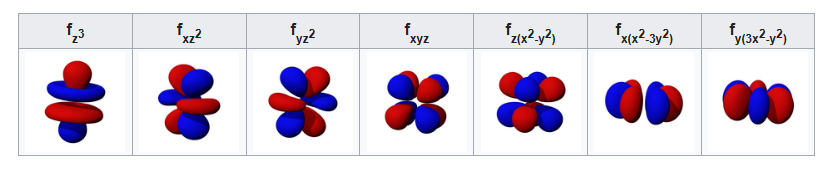
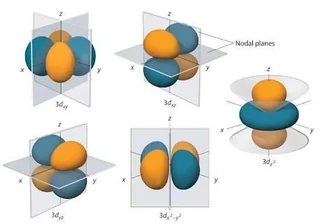
分子軌域